, 題目:
小腸黏膜下層(SIS)是一種被廣泛關注的用于重建組織缺損的無細胞材料,但在腹壁修復過程中,由于降解快導致長期力學性能差、細菌污染引起的感染以及術后新生血管不足而受到限制。
修復創(chuàng)傷引起的腹壁缺損、廣泛手術切除或疝氣仍然是一個挑戰(zhàn)[1]。目前,合成或生物材料已被用作恢復腹壁完整性的網(wǎng)狀物。合成材料,如聚丙烯,成為腹壁修復的標準護理[2]。然而,它們的植入物剛性和不可吸收性與慢性炎癥組織反應和高并發(fā)癥有關,包括感染、內(nèi)臟粘連、慢性疼痛、擠出和復發(fā)等[3,4]在這方面,由于具有出色的吸收性和生物相容性,生物材料顯示出優(yōu)于合成材料的優(yōu)勢[5].此外,生物材料已被證明在組織學和功能方面促進組織的建設性重塑和再生。因此,生物材料在腹壁缺損的修復中越來越受到關注。
作為一種廣泛使用的生物材料,小腸黏膜下層(SIS)是一種天然存在的細胞外基質(zhì)(ECM),具有豐富的膠原蛋白,最終可以被新的位點特異性組織取代,稱為組織內(nèi)源性再生[6,7]。與交聯(lián)生物網(wǎng)或任何其他基于膠原蛋白的材料相比,SIS含有多種生長因子,
為了進一步了解SIS和CS/ES-SIS復合材料在生物力學環(huán)境下的降解機制,我們研究了材料在降解過程中的微觀力學性能。納米壓痕測量適用于研究材料的微剛度。如表1所示,CS/ES-SIS復合材料的微剛度最初低于SIS,表明與CS/ES納米纖維結合的SIS可以降低其剛度。然而,在暴露于膠原酶后,CS / ES-SIS復合材料在隨后的所有暴露期后表現(xiàn)出比SIS更高的微觀剛度。降解7 d后,SIS的微剛度僅保持8.82 ±0.42 kPa,而CS/ES-SIS復合材料的微剛度可保持64.5 ±2.98 kPa。
表 1.生物力學環(huán)境下不同降解時間下SIS和CS/ES-SIS復合材料的微剛度.



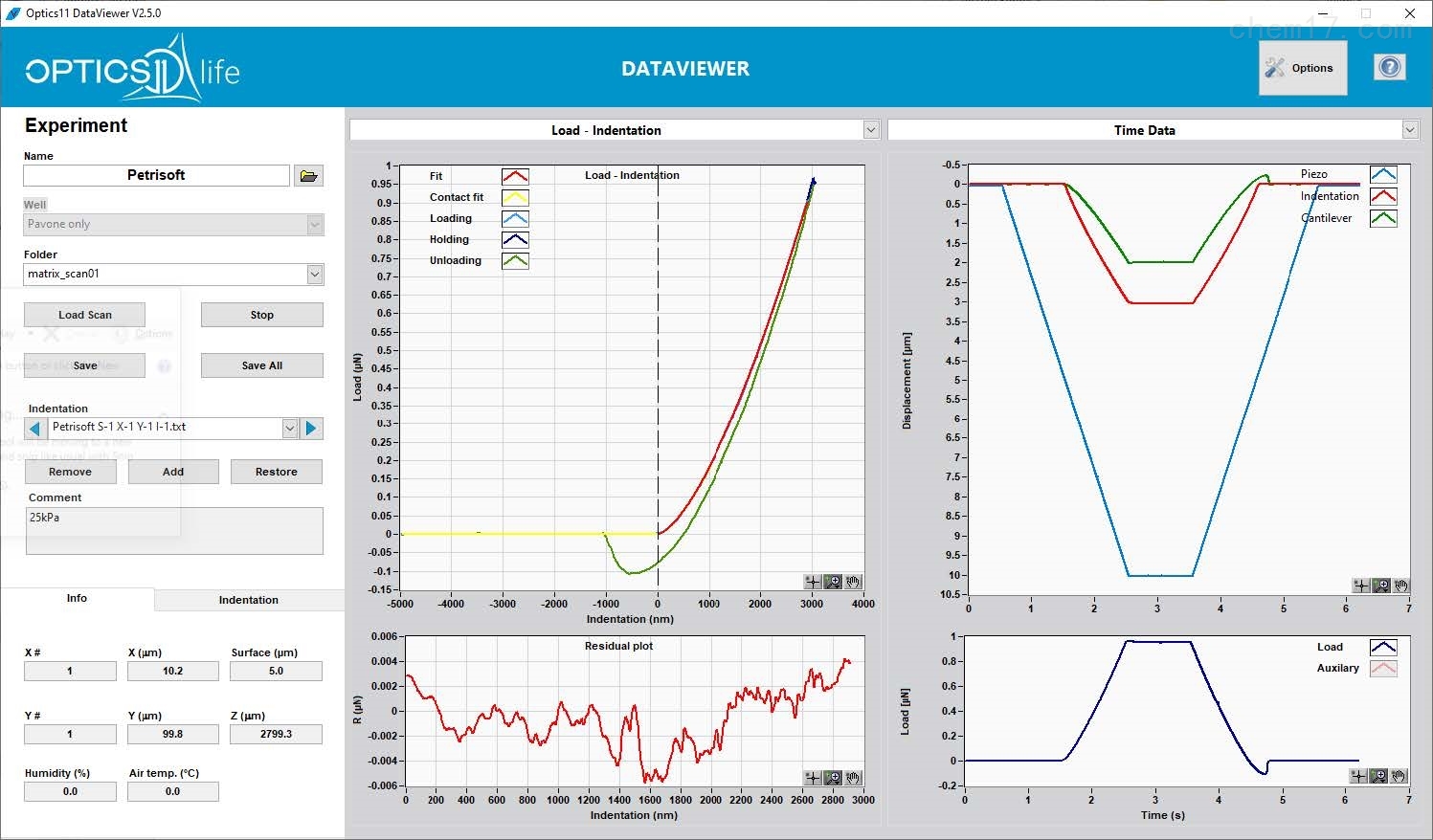
Piuma是功能強大的臺式儀器,可探索水凝膠、生理組織和生物工程材料的微觀機械特性。表征尺度從宏觀直至細胞。專為分析測試軟材料而設計,測量復雜和不規(guī)則材料在生理條件下的力學性能。杭州軒轅科技有限公司
● 內(nèi)置攝像鏡頭,方便實時觀察樣品臺
● 實時分析計算測量結果,原始數(shù)據(jù)并將以文本文件存儲,方便任何時候?qū)隓ataviewer軟件進行復雜處理
● 探針經(jīng)過預先校準,即插即用。對于時間敏感的樣品確保了快速測量
● 光纖干涉MEMS技術能夠以無損的方式測量即使是最軟的材料,并保證分辨率。同時探針可以重復使用Piuma軒轅納米壓痕儀Piuma軒轅納米壓痕儀
| 模量測試范圍 | 5 Pa - 1 GPa |
| 探頭懸臂剛度 | 0.025 - 200 N/m |
| 探頭尺寸(半徑) | 3 - 250 μm |
| 最大壓痕深度 | 100 μm |
| 傳感器最大容量 | 200 |
| 測試環(huán)境 | air, liquid (buffer/medium) |
| 粗調(diào)行程 | X*Y:12×12 mm Z:12 mm |
加載模式 | Displacement / Load* / Indentation* |
| 測試類型 | 準靜態(tài)(單點,矩陣) 蠕變,應力松弛 DMA動態(tài)掃描 (E', E'', tanδ) |
| 動態(tài)掃描頻率* | 0.1 - 10 Hz |
| 內(nèi)置擬合模型 | Young's Modulus (Hertz / Oliver-Pharr / JKR) |
| *為可選升級配置 | |
新型光纖干涉式懸臂梁探頭,利用干涉儀來監(jiān)測懸臂梁形變。
創(chuàng)新型光纖探頭,彌補了傳統(tǒng)納米壓痕儀無法測試軟物質(zhì)的問題,也解決了AFM在力學測試中的波動大,操作困難、制樣嚴苛等常見缺陷。
● 背景噪音低:激光干涉儀抗干擾強于AFM反射光路
● 制樣更簡單:對樣品的粗糙度寬容度高于AFM
● 剛度選擇更準確:平行懸臂梁結構有利于準確判別壓痕深度與壓電陶瓷位移比例關系,便于選擇合適剛度探頭來保證彈性形變關系的穩(wěn)定性,進而獲得重復率更高、準確性更好的數(shù)據(jù)
● 借助功能強大而易于操作的軟件,用戶可以自由控制壓痕程序(載荷、位移等)。自動處理曲線的流程,可以獲得數(shù)據(jù)和結果的快速分析
● 原始參數(shù)完整txt導出,便于后續(xù)復雜處理的需要
● 利用Hertz接觸模型從加載部分計算彈性模量,與常用的Oliver&Pharr方法相比,更為適合生物組織和軟物質(zhì)材料特性
| 年 份 | 期 刊 | 題 目 |
|---|---|---|
| 2022 | Advanced Functional Materials | Engineering Vascular Self-Assembly by Controlled 3D-Printed Cell Placement |
| 2022 | Biomaterials | Hydrogels derived from decellularized liver tissue support the growth and differentiation of cholangiocyte organoids |
| 2021 | Biofabrication | 3D bioprinting of tissue units with mesenchymal stem cells, retaining their proliferative and differentiating potential, in polyphosphate-containing bio-ink |
| 2021 | nature communications | Janus 3D printed dynamic scaffolds for nanovibration-driven bone regeneration |
| 2020 | Environmental Science & Technology | Effect of Nonphosphorus Corrosion Inhibitors on Biofilm Pore Structure and Mechanical Properties |
| 2020 | Acta Biomaterialia | A multilayer micromechanical elastic modulus measuring method in ex vivo human aneurysmal abdominal aortas |